发布时间:2025/03/27 点击数:440
发布时间:2025/03/27 点击数:440 评估Caco-2细胞在吸收、渗透性和生物利用度研究中的金标准地位:其局限性是否合理?
一则短讯
经过修订的“FDA现代化法案3.0”,于2024年12月12日以全票通过的结果获美国参议院批准(下图)。
美国立法者十分重视推动FDA实施FDA现代化法案2.0(FDAMA 2.0)的任务,这项于2022年12月成为法律的关键生物医学改革,取消了在药物研发中强制使用人工动物模型的要求,只要可以通过更先进、更具预测性的建模方法(如基于类器官和器官芯片培养的体外模型)来评估药物在人类中的安全性和有效性。
通过采用技术驱动的、与人类高度相关的材料和方法来进行药物研发和医疗发现,同时避免使用不可靠且具有误导性的动物试验,将彻底改变当前浪费严重的药物开发模式。

图:美国参议院通过FDA现代化法案3.0 [*]
前言
在药物研究领域,Caco-2细胞长期以来被誉为研究肠道吸收和通透性的黄金标准。人类上皮性结直肠腺癌细胞因其能够分化为肠细胞样细胞、形成模仿肠道屏障的紧密连接而受到重视。
然而,与其他模型系统一样,Caco-2细胞也有其自身的局限性。这提出了一个重要的问题:它们的局限性是否会削弱其黄金标准地位?是时候用更符合生理学的方法改进估计了吗?有哪些新方法可用,以及它们的好处是否足以抵消采用新方法所需的努力?
一、Caco-2细胞的优势
Caco-2细胞模型不可否认的优势和简便性,充分证明了它们为何在药物开发中长期以来一直是一种宝贵的工具。我们常听到一句话:“如果它没有坏,为什么要修理它?” 因此,推动变革的创新必须具备较大优势。那么,当Caco-2细胞以其以下特点而广为人知时,变革的驱动力是什么呢?
1. 预测能力:它们能够在Transwell插入物上形成紧密连接的单层细胞,从而可靠地预测被动扩散化合物的药物渗透性。
2. 可重复性:使用Caco-2细胞能够提供一致且可重复的结果,这对于对比研究和监管申报十分重要。
3. 使用便捷:这些细胞源自人类结肠癌,相对容易培养,因此实验室可以轻松获取。
我们认为,变革的驱动力与药物代谢有关。当药物通过口服途径进入人体时,其在肠道中的吸收和渗透仅仅是旅程的第一步。肠道是一个代谢活跃的器官;此外,在口服药物发挥其实际靶效应之前,还需考虑另一个重要器官——肝脏的影响。
目前,我们从Caco-2模型中获得体外吸收和渗透性数据,然后利用体外肝脏清除实验。然而,这种方法存在脱节,因为它未能考虑药物在肠道吸收和代谢后到达肝脏的药代动力学过程。因此,使用分离的实验方法在估算药物生物利用度时会留下令人担忧的认知空白。
二、为什么估算人类口服生物利用度是临床前研究中的一项挑战?
在临床研究之前,准确估算药物的生物利用度对于制定安全且有效的剂量十分重要,同时也是一项监管要求。从分离的体外测试中获得的数据可以用来推断药物的生物利用度,但这种方法仅在极端情况下能提供可操作的见解。尽管这些局限性可以通过体内动物生物利用度研究和计算模型(in silico)在一定程度上缓解,但它们也存在自身的不足。
1. 计算模型的局限性:计算模型的预测能力高度依赖于输入数据的质量。
2. 动物研究的局限性:由于生理和代谢能力的种属差异,动物研究的预测结果在人类中的可转化性较低。
Musther等人[1]在2014年开展的一项开创性研究调查了184种化合物,发现常用动物模型的生物利用度数据与人类数据的相关性较低(小鼠R²=0.25,大鼠R²=0.28,狗R²=0.37)。非人灵长类动物(NHP)模型在这方面表现更优,与人类的生物利用度相关性更高(R²=0.69)(下图),但由于重大的伦理问题、严格的监管要求以及高昂的成本,这些模型并不常用。
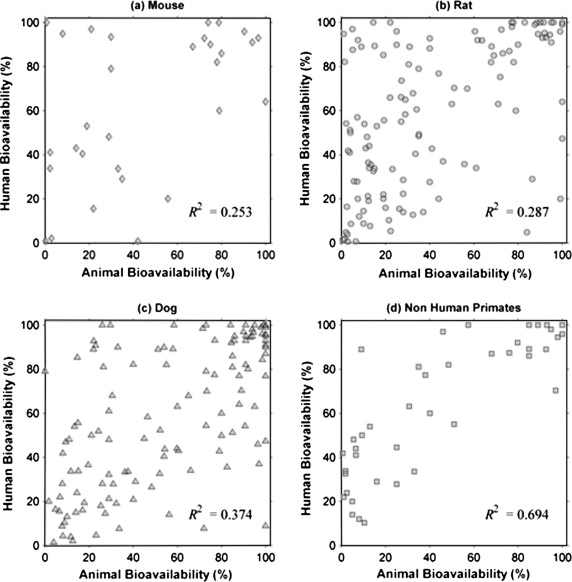
图:按物种划分的线性回归分析图(以百分比表示)每个图中均显示了线性回归的决定系数(R²)[1]
因此,临床前估算人类口服生物利用度是一个复杂的过程,需要整合多个来源的数据。通过采用更具人类相关性的研究方法改进这一过程,可能成为快速提升研究效率的一大突破点。
三、使用Caco-2细胞在体外模拟首过代谢过程
将测量药物吸收/渗透性的金标准方法与测量肝脏清除率的金标准方法流体连接起来,是提高从Caco-2细胞实验中获得数据价值的显而易见的步骤。微流控器官芯片供应商CN Bio通过开发一种肠道芯片模型探索了这一方法。具体来说,我们在Transwell插入物的基底侧培养了一种混合细胞模型,由肠道上皮细胞(Caco-2)和杯状细胞(HT29-MTX)组成,同时暴露于循环培养基中。
我们将Caco-2肠道芯片与经过高度表征和验证的原代人类肝脏芯片模型流体连接起来,后者已被美国FDA认可(这是Shou个器官芯片供应商与监管机构的合作出版物),其性能优于传统的静态肝脏培养方法[2](Rubiano等,2021)。
通过将这两种模型流体连接起来形成一个系统(下图),我们将此前孤立的实验整合为一个整体(使用PhysioMimix多器官系统和多芯片双器官板),在体外模拟首过代谢过程。这种方法的优势在于能够模拟静脉和口服给药,以评估每种模型的单独和联合贡献,从而推导出曲线下面积(AUC),即药物在肠道吸收和代谢后的药代动力学,并估算到达肝脏的比例,为生物利用度估算提供缺失的关键信息。
图:肝-肠双器官串联芯片
这种创新的肠/肝芯片模型(也称为肠/肝微生理系统,Gut/LiverMPS)的性能已由罗氏(Roche)公司使用前体药物霉酚酸酯(mycophenolate mofetil)进行评估[3](点击查看详情)(Milani等,2022)。然而,罗氏在其研究中指出,当处理这类药物时,Caco-2细胞模型存在一定的局限性,主要是因为羧酸酯酶1和2(CES1和CES2)的表达。在Caco-2细胞中,这些酶的表达既不符合生理水平,也不具有与人体相关性。这些酶对于酯类前体药物的水解至关重要,其缺乏可能影响含酯药物的代谢和吸收预测的准确性(下图)。
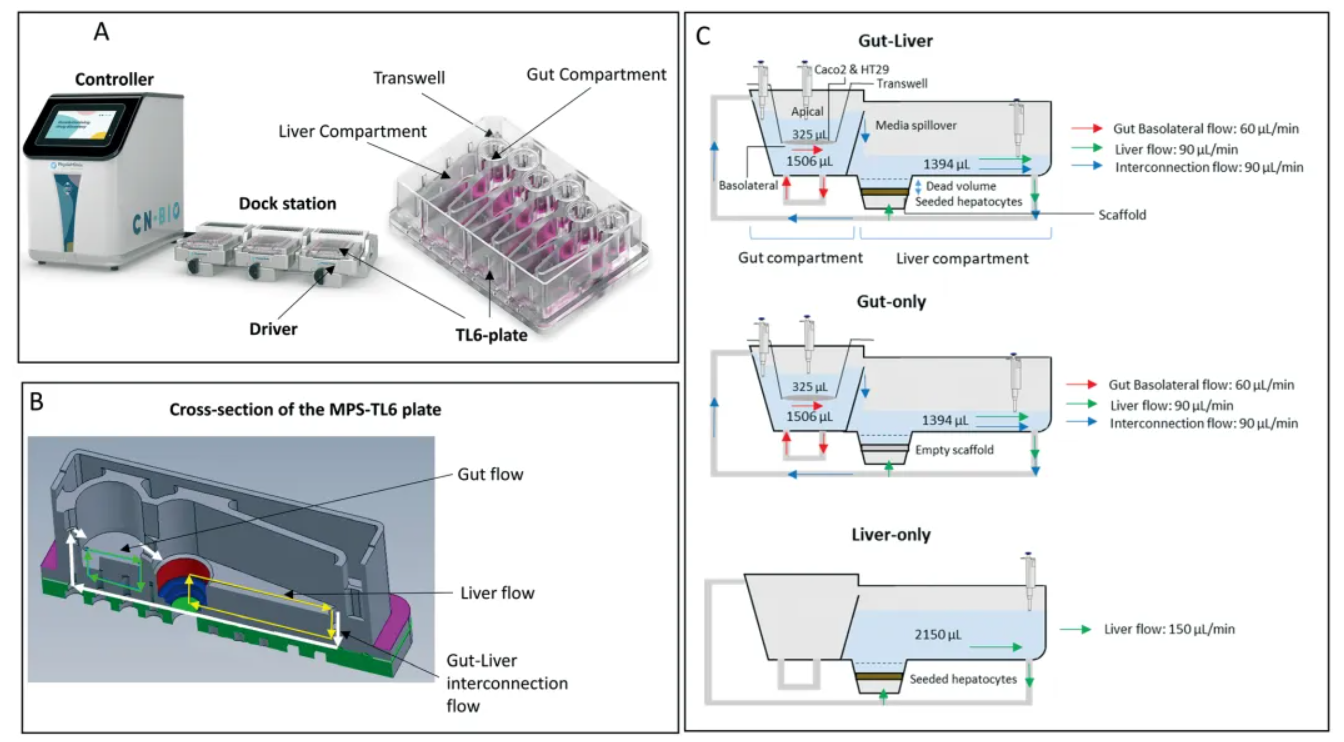
图:Roche使用的CN Bio PhysioMimix 肝-肠MPS展示
但这仅是Caco-2细胞众多局限性之一,而这些局限性限制了我们PhysioMimix生物利用度实验中双器官模型估算的准确性。
四、当两家微生理系统(MPS)提供商联手时
2024年1月,CN Bio宣布与Altis Biosystems建立紧密的战略合作伙伴关系。此合作使我们能够在双器官系统中,用Altis的原代人类RepliGut-Planar空肠模型替代我们原先使用的灌流Caco-2肠道芯片。RepliGut模型利用人类肠道干细胞创建的体外模型更接近人体,如下图:

图:咪达唑仑在两种肠/肝MPS模型的口服生物利用度,并与文献中发表的人类和动物数据进行了比较
RepliGut-Planar空肠模型克服了Caco-2细胞的额外局限性,包括:
1. 缺乏复杂性:虽然Caco-2细胞能够模拟肠道屏障,但无法完全再现人类肠道的复杂性。它们缺少肠道内多种细胞类型,这些细胞在吸收和渗透中扮演重要角色。
2. 粘液分泌:Caco-2细胞不分泌粘液,而RepliGut模型包含能够分泌粘液的杯状细胞,更好地模拟了体内环境。
3. 屏障完整性:RepliGut模型具有明显的细胞扩增阶段(主要是干细胞和祖细胞)和分化阶段(主要是分化细胞)。随着细胞成熟,其屏障完整性(通过跨上皮电阻TEER监测)逐渐增强,更接近高度再生的人类肠道特性。
4. 外排转运体的过度表达:Caco-2细胞缺乏关键的外排转运体(如P-糖蛋白),可能导致药物吸收的低估。而RepliGut模型的基因表达数据显示,随着细胞成熟,转运体的调控更加差异化,使Caco-2更像未成熟细胞。
5. 代谢酶表达:Caco-2细胞的Ⅰ相和Ⅱ相代谢酶表达有限,可能导致对药物代谢特征及潜在生物利用度的理解不完整。RepliGut模型表达了更符合生理的代谢酶水平,包括细胞色素P450(CYP)、UGT和CES酶,从而提高了药物代谢研究的准确性。
这一合作使我们迈出了重要一步,借助更先进的人类化肠道模型,进一步提升了双器官系统在药物代谢和生物利用度研究中的应用潜力。
五、使用原代人类RepliGut/Liver-on-a-chip模型改进体外人类生物利用度的评估能力,与单独使用Caco-2细胞的对比
研究中采用流体连接的RepliGut-Planar空肠/肝脏芯片模型(RepliGut-Planar空肠/肝脏MPS),测试了两种化合物(temocapril和midazolam),这些化合物的人体ADME特性未被现有模型准确预测。

1. Midazolam:这是一种通过CYP3A4酶在肠道和肝脏清除的药物,而Caco-2细胞中几乎不表达CYP3A4。
2. Temocapril:这是一种设计为抗肠道水解的前体药物,通过CES1代谢为temocaprilat。然而,CES1在Caco-2细胞中的表达明显高于人体,导致药物清除率被高估。
研究结果表明,原代双器官模型为体外独特地评估人类生物利用度提供了一种可行的替代方案,成功克服了Caco-2细胞系在人类相关性方面的局限性。
更多详细信息,欢迎联系我们获取原文。

结论
尽管Caco-2细胞存在局限性,其使用便捷性使其在初步筛选和对比研究中不可或缺。然而,关键在于将Caco-2研究与其他更具生理相关性的模型相结合。通过这种方式,可以全面了解人类肠道和肝脏的联合作用,从而更准确地在体外评估口服药物的生物利用度。
在药物发现早期生成更具人类相关性的数据,意味着可以在昂贵的临床前体内研究之前发现并解决潜在问题。由于RepliGut/Liver-on-a-chip模型完全由原代人类细胞组成,无需考虑种属差异,因此可用于克服动物模型ADME预测与人类结果之间的弱相关性。通过弥合体外实验与体内研究之间的差距,该模型使研究人员能够更自信地推进最有前景的药物候选物,从而降低成本并减少动物使用量。
正因如此,我们认为变革的益处远远超过维持现状的好处,预计通过将动态模型整合到ADME/DMPK研究工具中,金标准将被重新定义。
因此,不要拖延解决ADME药物开发中的挑战!等待的时间越长,临床前估算误差导致的问题逐步扩大的风险就越大。
扩展阅读
参考文献
[1] Animal versus human oral drug bioavailability: Do they correlate? https://doi.org/10.1016/j.ejps.2013.08.018
[2] Characterizing the reproducibility in using a liver microphysiological system for assaying drug toxicity, metabolism, and accumulation. https://doi.org/10.1111/cts.12969
[3] Application of a gut–liver-on-a-chip device and mechanistic modelling to the quantitative in vitro pharmacokinetic study of mycophenolate mofetil.DOI: 10.1039/D2LC00276K
[*] https://animalwellnessaction.org/u-s-senate-passes-fda-modernization-act