发布时间:2025/03/05 点击数:82
发布时间:2025/03/05 点击数:82 在再生医学的前沿,多能干细胞(PSCs)领域正迅速向临床和商业领域迈进。然而,制造过程中的可重复性和稳健性为工艺开发的主要瓶颈。本研究利用垂直轮(VW)生物反应器系统,对五种PSC商业化培养基进行了短期和长期扩增人类诱导多能干细胞(hiPSCs)的性能评估,以期在动态培养环境中实现大规模、高质量的hiPSCs扩增。
一、研究背景
PSCs因其自我更新和多向分化能力而成为再生医学的基石。然而,传统的静态培养方法难以满足临床或商业应用中对很多细胞的需求。因此,开发可扩展的生物反应器系统以实现PSCs的大规模扩增显得尤为重要。本研究旨在评估不同商业化培养基在VW生物反应器中扩增hiPSCs的效果,以及这些培养基在连续传代中的表现。
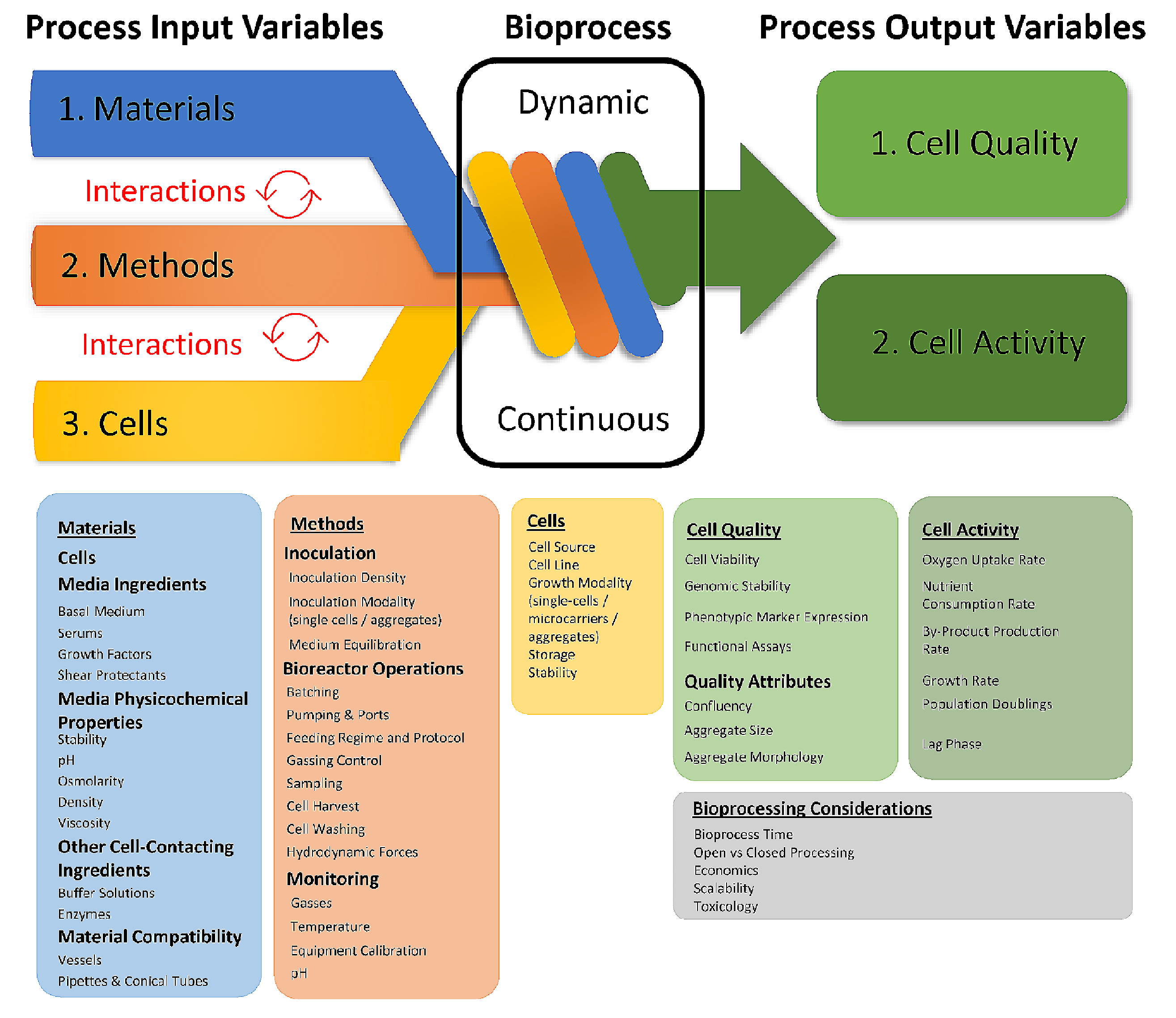
图1.生物工艺过程图,突出了一些过程输入变量(PIVs)和过程输出变量(POVs)的例子。在设计生物过程时,考虑关键的PIVs以及它们将如何各自或与其他变量协同影响生物工艺过程非常重要。此外,由于生物工艺过程是一个连续且动态的过程,理解它将如何响应不同的PIVs以及对主要/关键POVs的影响很重要。每个框图概述了在设计过程时需要考虑的PIVs和POVs。
二、实验方法与材料
本研究采用为PBS垂直轮生物反应器中 PSC 聚集体短期培养而开发的基线方案,通过长期(连续传代)悬浮培养来评估关键工艺属性。这样做是为了在使用不同市售培养基和细胞系时评估整体工艺的稳健性。
本研究用了三种hiPSC细胞系:4YA、TC1133和PLX1。在生物反应器培养前,细胞均在Matrigel包被的T-75培养瓶中使用mTeSR1培养基进行静态培养。随后,细胞被接种到PBS-0.1 Mini VW生物反应器中,使用五种不同的商业化培养基:mTeSR1、CTS E8、StemFlex、PluriStem和NutriStem。通过维持恒定的搅拌速度和定期的培养基更换,对细胞生长动力学、聚集体形态、收获效率、基因组稳定性和功能性多能性等关键过程输出变量(POVs)进行了评估。
三、研究结果
关键数据概览
1、iPSC生长动力学:StemFlex培养基在6天内实现了较大的扩增倍数(47.0 ± 1.8),而其他培养基则实现了约30倍的扩增。
2、iPSC聚集体形态:不同培养基的平均聚集体直径不同,CTS E8培养基展示了较大的平均聚集体直径,而PluriStem和NutriStem则较小。
3、iPSC收获效率:StemFlex和mTeSR1培养基的收获效率接近100%,而CTS E8、PluriStem和NutriStem的收获效率分别为29%、69%和47%。
4、iPSC长期连续传代:StemFlex和mTeSR1培养基在三次连续传代中保持了一致的细胞生长。而CTS E8、PluriStem和NutriStem在随后的传代中细胞生长减少,到第三次生物反应器传代时几乎没有生长。
5、iPSC基因组稳定性和功能性多能性:通过G带核型分析和畸胎瘤形成实验,证实了在StemFlex培养基中培养的hiPSCs在第三次和第十次传代时保持了遗传稳定性和多能性。
总结
1、在六天培养期间,测试的商业化培养基均显示出高倍数扩增和球形聚集体形成。
2、长期连续传代和生物反应器内解离操作揭示了细胞生长和质量的明显差异。
3、某些商业化培养基在连续传代培养中表现不佳,导致细胞裂解、生长速率降低和聚集体形态丧失。
4、通过多个hiPSC系的连续传代,展示了良好的生物过程稳健性,即使在10次连续生物反应器传代中也能维持生长和质量。
5、一些商业化培养基在生物反应器传代中证明不适合,因为它们在解离过程中导致细胞裂解,降低了生长速率,并丧失了聚集体形态。
6、研究强调了系统选择和测试生物过程输入变量的重要性,通过连续传代创建可复制和稳健的协议,以实现临床和商业PSC生产。
(以下详细数据结果,看完预计需要10分钟)
3.1 生物反应器培养工艺中iPSC培养基筛选
生物反应器的过程输入变量(PIVs)除了使用的培养基类型外都是相同的。在这些条件下,所测试的培养基都能成功地在生物反应器中培养hiPSCs聚集体。这通过两个标准来评估:(i)球形聚集体形态,边缘平滑且定义明确,缺乏半透明的囊状结构;以及(ii)细胞生长没有长时间的滞后阶段,并且生长速率与当前文献中发现的较大值相当。后者对所有测试的培养基都得到了支持(图2B)。StemFlex在6天内实现了较大的扩增倍数47.0 ± (1.8),而其他培养基在6天内实现了约30倍的扩增,如图2C所示。关于聚集体形态,聚集体的平均直径根据测试的培养基不同而有所变化;CTS E8培养基展示了较大的平均聚集体直径,而PluriStem和NutriStem则较小(图2D)。在PluriStem培养基中也观察到在晚期时间点球形形态较少,而其他培养基在整个培养期间都呈现球形形态(图2E)。
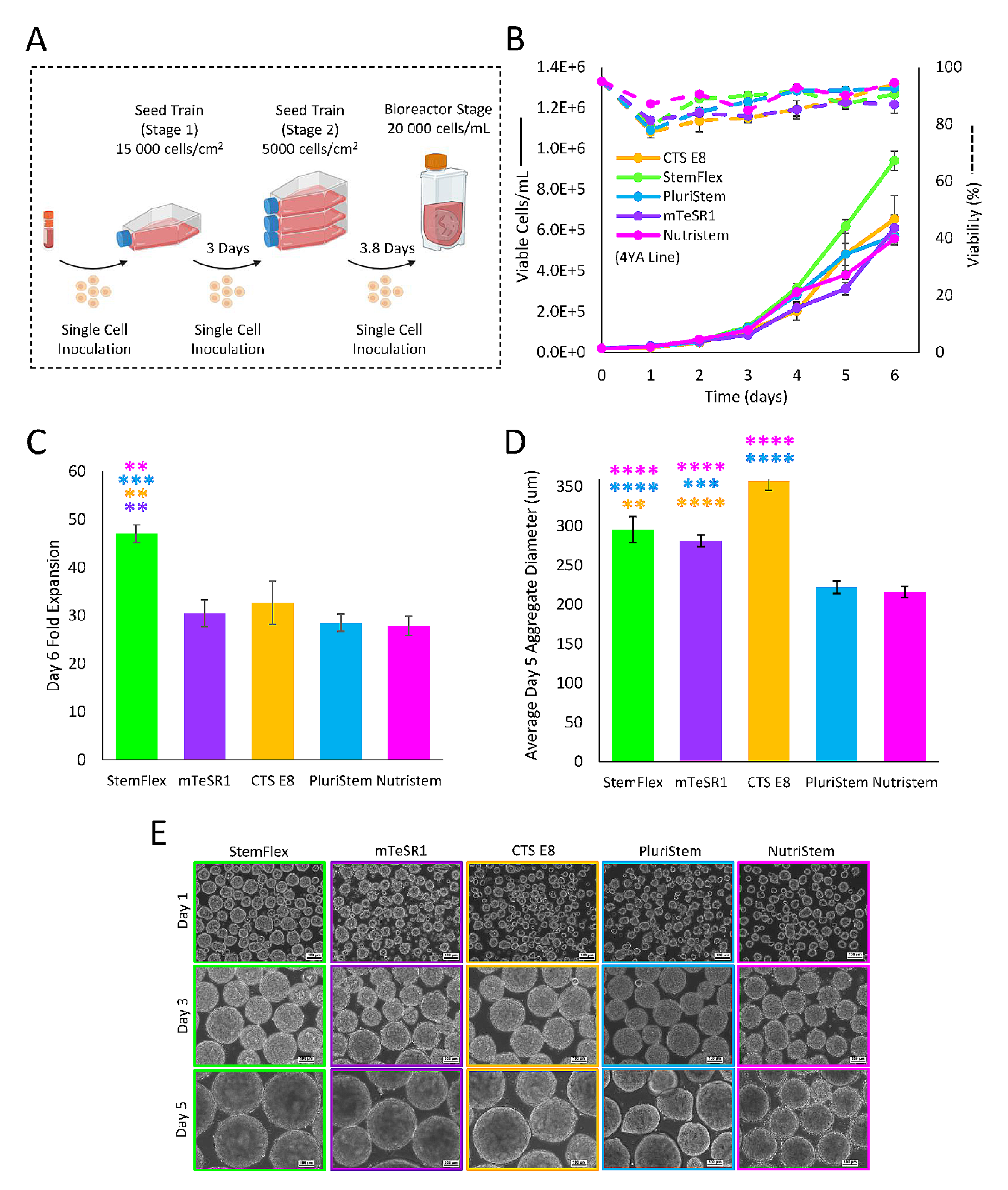
图2.展示了五种不同培养基在六天内的hiPSCs生长曲线和扩增倍数
(A)为在接种到0.1 L Mini垂直轮生物反应器之前用于起始扩增hiPSCs的静态种子训练示意图。
(B-C)在0.1 L Mini中培养的hiPSCs的六天生长曲线以及每种培养基的第六天扩增倍数
(D-E)第五天的平均聚集体直径以及每种培养基在培养D1、D3和D5的代表性的相差显微镜图像(10x)。
3.2 在垂直轮生物反应器中扩增后进行容器内iPSC聚集体的解离
在六天的扩增后,对所测试的培养基采用了一种容器内聚集体解离的方案(如图3A)。尽管所测试的商业培养基在PBS-0.1 Mini生物反应器中都成功扩增,但在使用容器内聚集体解离方案后,细胞质量出现了显著差异。如图3B所示,StemFlex和mTeSR1培养的细胞聚集体获得了高收获效率,显示出约100%的恢复率。相反,CTS E8、PluriStem和NutriStem培养的细胞收获效率较低,分别为29%、69%和47%。在观察到高容器内解离效率的情况下(mTeSR1和StemFlex),解离后的细胞活力保持在90%以上,与样本计数的细胞活力相当(图3C)。值得注意的是,尽管CTS E8、PluriStem和NutriStem培养下的细胞计数在容器内解离后明显降低,但细胞活力并没有显示出同样的明显下降,分别由自动化NC-200细胞分析仪测量为88%、89%和81%。这可能表明,单活力参数(即或至少是本研究中使用的方法测量的活力)不是下游处理中细胞健康的好指标。
除了收获效率的差异外,解离protocol对细胞质量的影响还通过明场显微镜进行了可视化。在PBS-0.1 Mini生物反应器中用StemFlex和mTeSR1培养的聚集体成功解离成主要是单细胞的形式,显微镜下或宏观上可见的细胞碎片很少。然而,在CTS E8、PluriStem和NutriStem条件下却产生了许多解离不佳的聚集体和细胞碎片。这在搅拌20分钟后,对生物反应器内的上清液进行宏观比较时更加明显。图3E展示了成功和不成功的容器内解离过程中观察到的代表性图像,其中mTeSR1条件被展示为成功的容器内解离示例。Accutase溶液因聚集体解离产生的浓缩单细胞而变得更加浑浊,没有宏观可见的细胞聚集体残留或细胞碎片形成。在CTS E8条件下,Accutase与单细胞的混浊度较低,并且有许多可见的细胞碎片串附着在粘性的DNA上,表明细胞裂解。
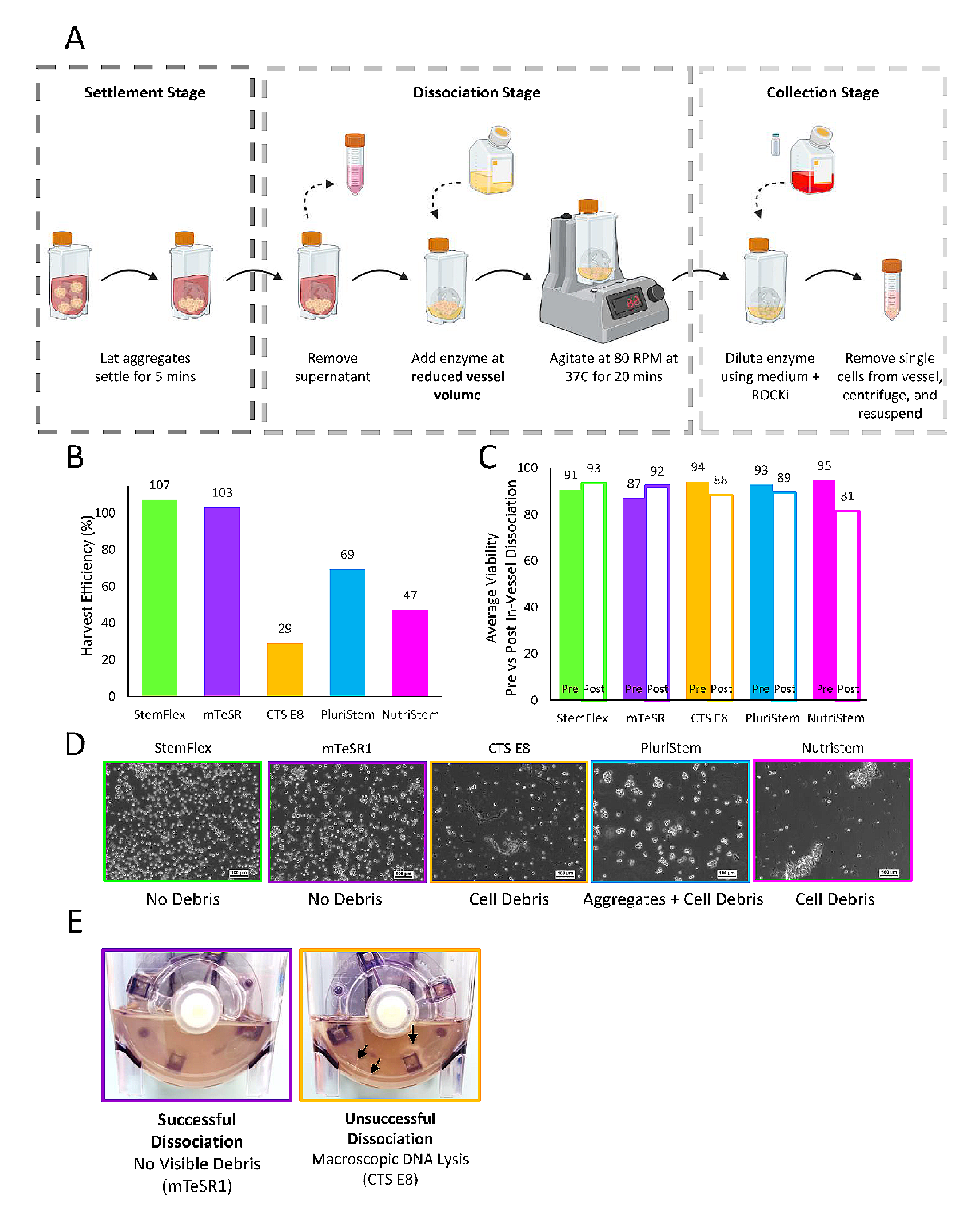
图3.展示了在培养第6天用于将聚集体解离成单细胞的容器内解离方案的示意图(A)
(B)展示了容器内解离过程后的收获效率
(C)每种培养基在解离前后的平均活力
(D)每种培养基在解离协议后的细胞悬浮液的代表性相差显微镜图像(10倍放大)
(E)展示了成功解离(左面板为mTeSR1)和不成功解离(右面板为CTS E8)的比较
3.3 PBS生物反应器内连续传代培养3代及10代后细胞的生长情况
在经过初步筛选后,五种不同的商业化培养基在三轮连续培养(长时间培养)中进行了评估。研究表明,StemFlex和mTeSR1培养基在每一轮培养中均展现了稳定的细胞生长,且保持了高倍增效应,而CTS E8、PluriStem和NutriStem培养基在连续培养中导致细胞增殖减少,至第三轮培养时几乎没有生长。此外,使用StemFlex和mTeSR1培养基的细胞团在形态上保持正常球形,而其他三种培养基则在二轮培养后出现形态变化,且到第三轮培养时,细胞的增殖能力明显下降。
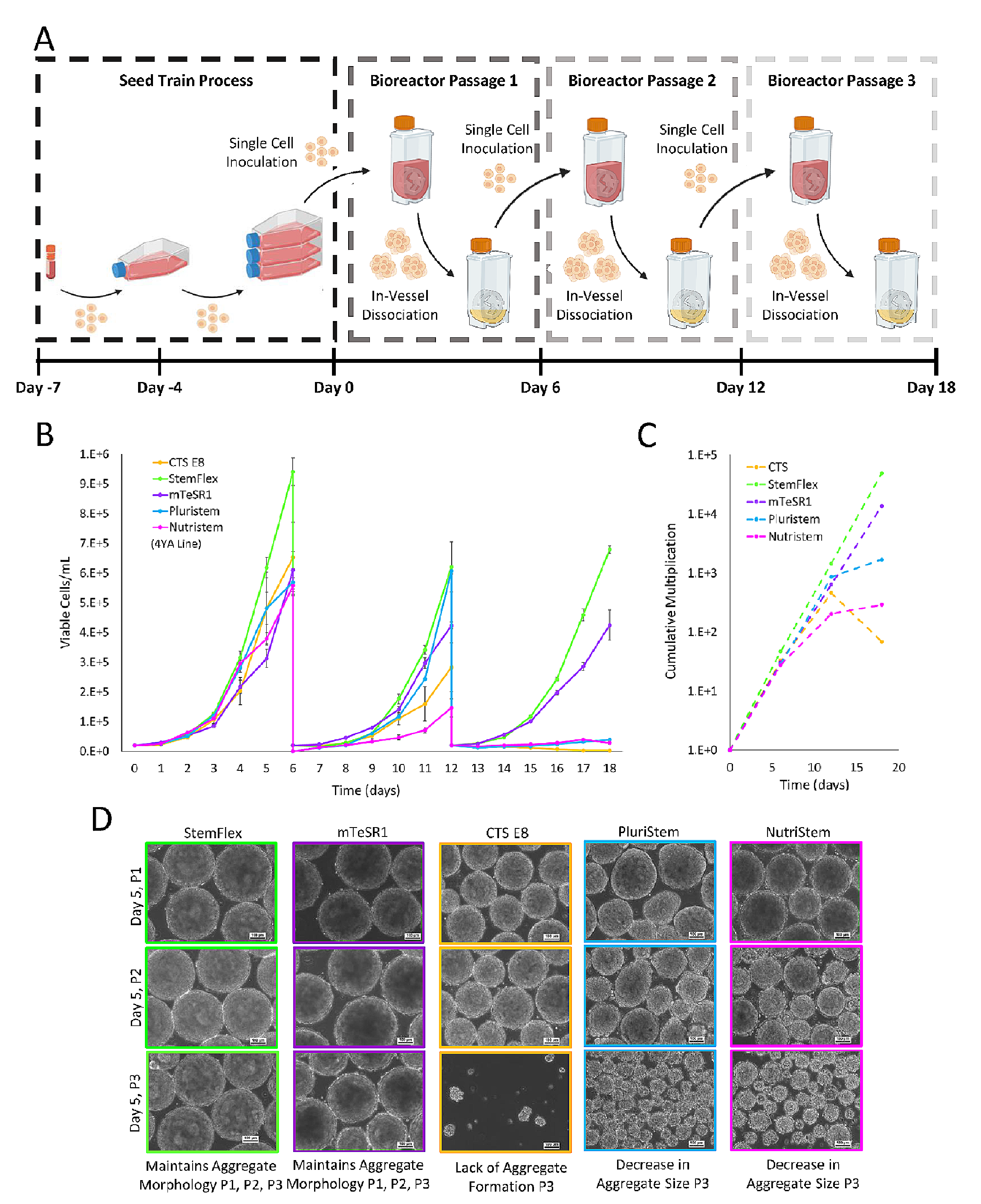
图4.展示了不同培养基条件下连续传代中细胞生长和聚集体形态的变化
(A)在0.1L Mini生物反应器中将细胞从种子培养阶段连续传代三次至第三次传代结束的过程示意图。
(B)三个连续传代的生长曲线;
(C)以及每个测试培养基的累积倍增比;
(D)每个培养基在一次传代(P1)第5天、二次传代(P2)和三次传代(P3)时的代表性相差显微镜图像(10x)。
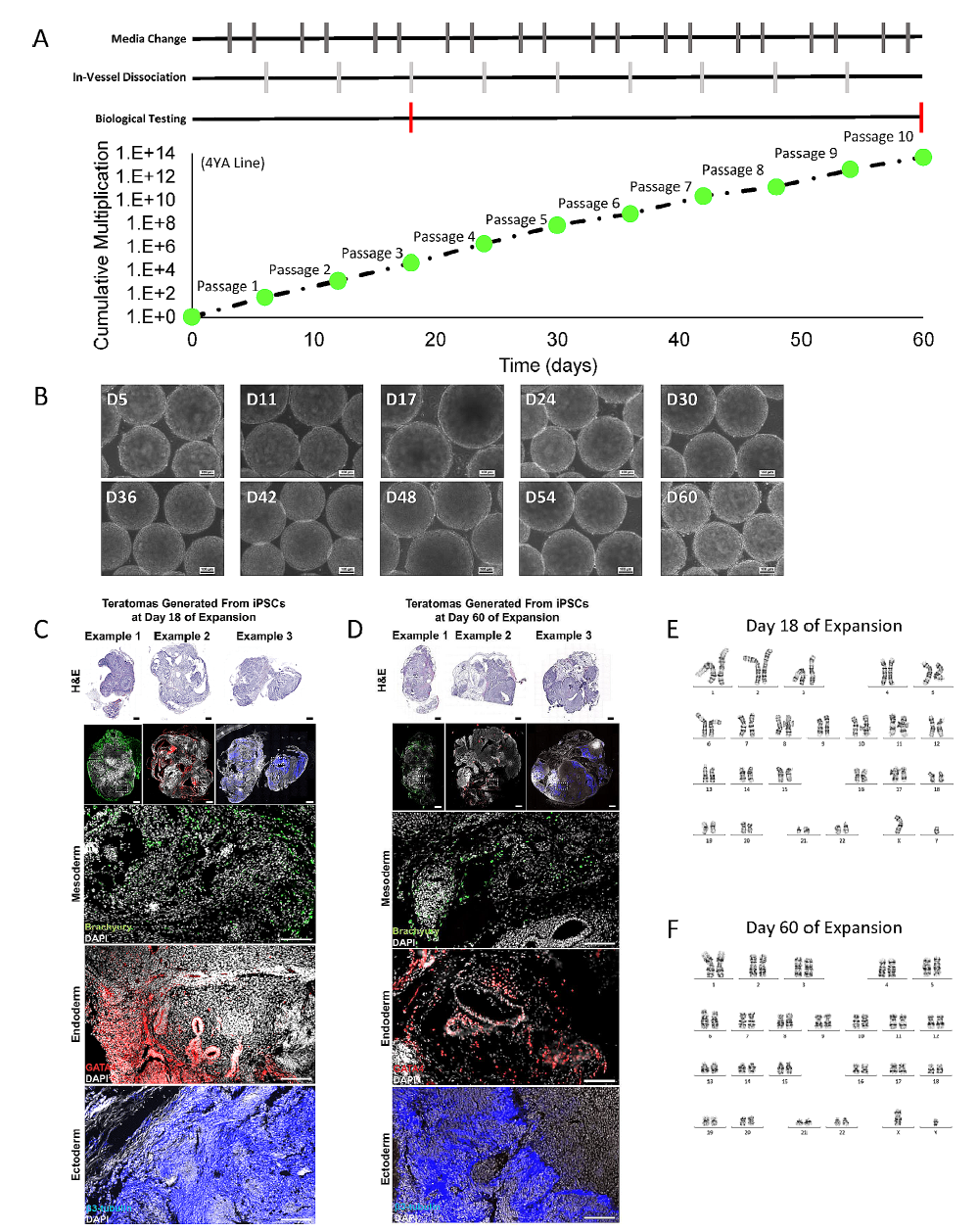
图5. 在StemFlex培养基下连续传代10次,维持细胞生长速率和聚集体形态的一致性。
(A)累积倍增比,以及进行培养基更换、生物反应器内解离和生物学检测(包括核型分析和畸胎瘤形成)的时间线。
(B)在每次传代结束时的代表性相差显微镜图像(10x)
(C-D)分别为在第三次和第十次传代结束时进行畸胎瘤形成的生物学检测,形成了来自三个胚层的组织,表明体内具有多能性。
(E-F)在第三次和第十次传代结束时还进行了G带核型分析。
3.4 使用额外的hiPSC系验证protocol的稳健性
为了进一步评估流程的稳健性,额外的商业化hiPSC系TC1133和PLX1在PBS-0.1迷你生物反应器中使用StemFlex和mTeSR1培养基进行了三次连续传代的扩增。
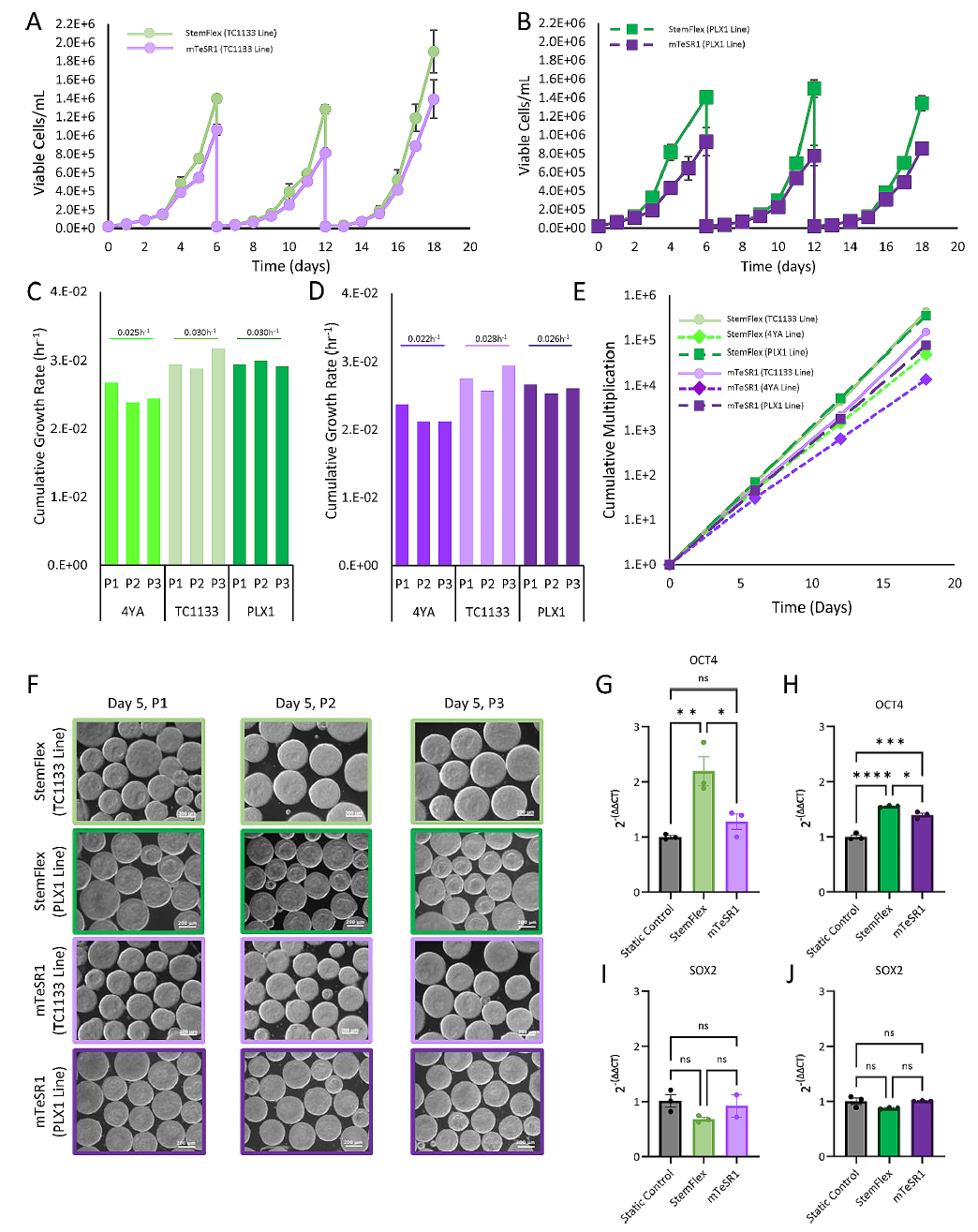
图6. hiPSC系TC1133(A)和PLX1(B)在StemFlex和mTeSR1培养基中进行三次连续传代的生长曲线。
(C-D)所测试的hiPSC系在StemFlex和mTeSR1中每次传代的累积增长率。
(E)所测试的hiPSC系在StemFlex和mTeSR1中的累积倍增比。
(F)TC1133和PLX1细胞团在StemFlex或mTeSR1中培养,在一次传代(P1)第5天、二次传代(P2)和三次传代(P3)的代表性相差显微镜图像(10x)。
(I-J)定量PCR评估与多能性相关的基因Oct4对于TC1133系(G)和PLX1(H),以及Sox2对于相应系。在静态条件下培养的TC1133和PLX1 hiPSCs被用作对照,以比较在三次连续传代后在生物反应器条件下扩增的细胞的相对表达。
结论
本研究强调了系统选择和测试生物过程输入变量(PIVs)的重要性,并通过连续传代创建可复制和稳健的protocol,以实现临床和商业PSC生产。并评估了不同商业化培养基的性能发现StemFlex和mTeSR1培养基能够有效用于hiPSCs的长期悬浮培养,这为从小规模和短期PSC protocol向可predictive的稳健生物过程转变奠定了基础。
参考文献
Robust bioprocess design and evaluation of commercial media for the serial expansion of human induced pluripotent stem cell aggregate cultures in vertical-wheel bioreactors.
注:此篇文章中用到的商业化培养基种类有限,并未将其他培养基的测试结果纳入其中。如您想要在PBS反应器中做iPSC扩增或分化测试,可以联系曼博生物提供更多的技术支持。